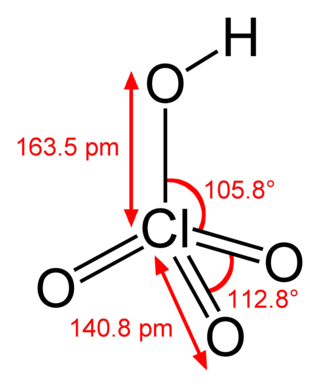
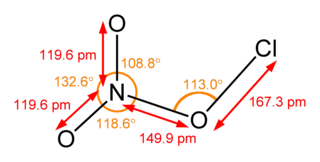
Хлориды

Хлори́ды — химические соединения хлора с менее электроотрицательными элементами, в которых он проявляет степень окисления −1[1].
По характеру химической связи хлор — элемент подразделяются на ионные и ковалентные. К ионным хлоридам относят соли соляной кислоты и щелочных, щелочноземельных металлов, аммония и алкиламмония, d- и f-элементов. Большинство ионных хлоридов в водных растворах диссоциированы на катион металла или аммония и хлорид-анион, отдельные их представители — AgCl, CuCl, Hg2Cl2, PbCl2 — в воде малорастворимы. Характерными представителями ковалентных хлоридов являются многие бинарные соединения хлора и неметаллов, например, NCl3, SCl4, а также переходных металлов, например, TiCl4, имеющие ковалентные полярные связи. Ковалентным перхлоратам свойственны реакции полного гидролиза. Хлориды брома и иода относят к межгалогенным соединениям. Отдельные хлориды неметаллов представляют собой комплексные соединения, например, хлорид фосфора(V) PCl5 в твёрдом состоянии представляет собой ионное соединение [PCl4]+[PCl5]−[1].
Физические свойства
Большинство хлоридов металлов (за исключением AgCl, CuCl, AuCl, Hg2Cl2, TlCl и PbCl2) хорошо растворимы в воде.
| Элемент | Формула | Цвет | tпл,°С | tкип,°С | Плотность (при 25 °C), г/см³ | Растворимость в воде (при 25 °C), г/л |
|---|---|---|---|---|---|---|
| H | HCl | бесцветный | −114,8 | −85,03 | 1,477 | 720 |
| He | − | |||||
| Li | LiCl | бесцветный | 605 | >1300 | 2,07 | 820 |
| Be | BeCl2 | белый | 415 | 520 | 1,9 | 151 |
| B | BCl3 | бесцветный | −107,3 | 12,6 | 1,343 (11 °C) | гидролиз до H3BO3 |
| C | CCl4 | бесцветный | −22,92 | 76,72 | 1,594 | 0,8 (20 °C) |
| N | NCl3 | жёлтый | −40 | 71 | 1,635 | гидролиз до NH3 и HOCl |
| O | − | |||||
| F | − | |||||
| Ne | − | |||||
| Na | NaCl | бесцветный | 800,8 | 1465 | 2,165 | 359 (20 °C) |
| Mg | MgCl2 | бесцветный | 713 | 1412 | 2,316 | 542 (20 °C) |
| Al | AlCl3 | бесцветный | − | 180 (возг.) | 2,48 | 458 |
| Si | SiCl4 | бесцветный | −70 | 57,5 | 1,48 | гидролиз до H2SiO3 и HCl |
| P | PCl3 | бесцветный | −93,6 | 76,1 | 1,574 | гидролиз до H3PO3 и HCl |
| PCl5 | бесцветный | − | 159 (возг.) | 1,6 | гидролиз до H3PO4 и HCl | |
| S | SCl2 | тёмно-красный | −121 | 59 | 1,621 | гидролиз |
| Cl | − | |||||
| Ar | − | |||||
| K | KCl | белый | 770 | 1420 | 1,984 | 340 (20 °C) |
| Ca | CaCl2 | белый | 772 | 1935 | 2,15 | 745 (20 °C) |
| Sc | ScCl3 | сероватый | − | 960 (возг.) | 2,39 | |
| Ti | TiCl2 | чёрный | 1035 | 1500 | 3,13 | |
| TiCl3 | красно-фиолетовый | 425 (разл.) | − | 2,64 | ||
| TiCl4 | бесцветный | −24,8 | 136,4 | 1,726 | гидролиз | |
| V | VCl2 | светло-зелёный | 1027 | 1506 | 3,23 | |
| VCl3 | фиолетовый | >300 (разл.) | − | 3 | ||
| VCl4 | ярко-красный | −28 | 154 | 1,816 | гидролиз | |
| Cr | CrCl2 | белый | 824 | 1120 | 2,9 | |
| CrCl3 | фиолетовый | 600 (разл.) | − | 2,89 | ||
| Mn | MnCl2 | розовый | 654 | 1225 | 2,98 | 739 (20 °C) |
| Fe | FeCl2 | бесцветный | 877 | 1023 | 3,16 | 685 (20 °C) |
| FeCl3 | тёмно-красный/тёмно-зелёный | 315 (разл.) | − | 2,898 | 920 (20 °C) | |
| Co | CoCl2 | голубой | 735 | 1049 | 3,356 | 529 (20 °C) |
| Ni | NiCl2 | жёлто-зелёный | 1001 | 3,55 | 650 (20 °C) | |
| Cu | CuCl | буро-желтый | − | 1490 (возг.) | 4,145 | 6,2⋅10−3 (20 °C) |
| CuCl2 | бирюзовый | − | 993 (возг.) | 3,386 | 757 | |
| Zn | ZnCl2 | белый | 292 | 756 | 2,907 | 4320 |
| Ga | GaCl2 | белый | 175 | 595 | 2,4173 | |
| GaCl3 | бесцветный | 77,9 | 201 | 2,47 | ||
| Ge | GeCl2 | белый→жёлтый | 74,6 | 450 | ||
| GeCl4 | бесцветный | −49,5 | 86,5 | 1,876 (20 °C) | гидролиз | |
| As | AsCl3 | бесцветный | −16,2 | 130,2 | 2,163 | гидролиз |
| AsCl5 | бесцветный | −50 (разл.) | − | |||
| Se | Se2Cl2 | красновато-коричневый | −85 | 127 | 2,7741 | гидролиз |
| SeCl4 | светло-жёлтый | − | 196 (возг.) | 2,6 | гидролиз | |
| Br | BrCl | желтовато-красный | −54 | 5,5 (разл.) | 2,172 | гидролиз |
| Kr | − | |||||
| Rb | RbCl | белый | 718 | 1390 | 2,80 | 910 (20 °C) |
| Sr | SrCl2 | белый | 874 | 1250 | 3,052 | 538 (20 °C) |
| Y | YCl3 | белый | 721 | 1507 | 2,67 | 820 |
| Zr | ZrCl2 | чёрный | − | 727 (возг.) | 3,6 | гидролиз |
| ZrCl3 | синевато-чёрный | − | 770 (возг.) | 3,05 | гидролиз | |
| ZrCl4 | бесцветный | − | 331 (возг.) | 2,803 | гидролиз | |
| Nb | NbCl3 | чёрный | 1000 (разл.) | − | ||
| NbCl4 | тёмно-фиолетовый | 800 (разл.) | − | 3,2 | гидролиз | |
| NbCl5 | светло-жёлтый | 204,7 | 248,2 | 2,75 | гидролиз | |
| Mo | MoCl2 | жёлтый | 3,714 | |||
| MoCl3 | тёмно-красный | 410 (разл.) | − | 3,58 | ||
| MoCl4 | чёрный | 317 | 322 | 2,75 | гидролиз | |
| MoCl5 | чёрный | 194,4 | 269 | 2,928 | гидролиз | |
| Tc | TcCl4 | тёмно-красный | − | 300 (возг.) | 3,3 | гидролиз |
| Ru | RuCl2 | коричневый | ||||
| RuCl3 | чёрно-коричневый | 500 (разл.) | − | 3,11 | ||
| RuCl4 | коричневый | |||||
| Rh | RhCl2 | |||||
| RhCl3 | красно-коричневый | 842 | 1323 | 5,38 | ||
| RhCl4 | ||||||
| Pd | PdCl2 | тёмно-красный | 679 (разл.) | − | 4,00 | |
| Ag | AgCl | белый | 455 | 1550 | 5,56 | 1,88⋅10−3 |
| Cd | CdCl2 | бесцветный | 568 | 964 | 4,047 | 1140 |
Химические свойства

Ионные хлориды, образованные катионами щелочных или щелочноземельных металлов практически не подвержены гидролизу; в случае катионов, соответствующих слабым основаниям, гидролиз протекатет обратимо с образованием кислой среды в водном растворе. Ковалентные хлориды гидролизуются необратимо с образованием кислот:
Ионные и ковалентные хлориды могут взаимодействовать между собой с образованием комплексных соединений:
Получение хлоридов
- Хлорированием простых веществ хлором:
- Взаимодействием с сухим хлороводородом:
- Обработкой оксидов или гидроксидов хлороводородом или соляной кислотой:
- Взаимодействием оксидов с хлором в присутствии угля:
Примеры хлоридов, распространенных в природе
- Хлорид натрия (NaCl) — галит, широко известен как пищевая соль, основной компонент морской соли;
- Хлорид калия (KCl) — сильвин, распространенное калийное удобрение;
- Хлорид магния (MgCl2) — бишофит, сырьё для производства металлического магния.
Примеры сложносоставных хлоридов
- Хлорид-дибромид тиофосфорила (PSBr2Cl) — хлор-бромангидрид тиофосфорной кислоты
- Хлорид трифторометилсульфинилртути (Hg(SCF3)Cl) — фторорганические соединения
Литература
- Химическая энциклопедия : [рус.] : в 5 т. / под ред. Н. С. Зефирова. — М. : Большая российская энциклопедия, 1999. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
Примечания
- ↑ 1 2 Химическая Энциклопедия, 1999, Т. 5, с. 285–286.

![{\displaystyle {\mathsf {2KCl+TeCl_{4}\rightarrow K_{2}[TeCl_{6}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d5fbe71bcf801f3e2d528b394f9591e82b431a51)

![{\displaystyle {\mathsf {Cr+2HCl{\xrightarrow[{}]{600^{o}C}}CrCl_{2}+H_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7d1e6cd16c1afa9e8ab7aba1543600d20a1e77b)