Цианид кальция
| Цианид кальция | |
|---|---|
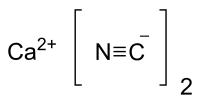 | |
| Общие | |
| Систематическое наименование | Цианид кальция |
| Традиционные названия | Цианистый кальций, кальциан; кальцианид |
| Хим. формула | Ca(CN)2 |
| Рац. формула | Ca(CN)2 |
| Физические свойства | |
| Состояние | Твёрдое |
| Молярная масса | 92,11 г/моль |
| Плотность | 1,853 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 640 °C |
| Классификация | |
| Рег. номер CAS | 592-01-8 |
| PubChem | 11590 |
| Рег. номер EINECS | 209-740-0 |
| SMILES | |
| InChI | |
| ChemSpider | 11102 |
| Безопасность | |
| Предельная концентрация | 0,3 мг/м3 |
| ЛД50 | 12 мг/кг |
| Токсичность | Чрезвычайно токсичен, один из сильнейших ядов |
| Пиктограммы ECB | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Циани́д ка́льция (циа́нистый ка́льций, в просторечии - кальциан, кальцианид, химическая формула — Ca(CN)2) — неорганическая кальциевая соль синильной кислоты.
При нормальных условиях, цианид кальция — белый порошок или кристаллы (технический продукт — черно-серный порошок [1]).
Физические свойства
Имеет характерный запах горького миндаля, типичный для цианидов. В водных растворах и во влажном воздухе гидролизуется, выделяя при этом циановодород.[1] Как и другие цианиды, очень токсичен.[2]
Химические свойства
- Взаимодействие с водой (гидролиз) приводит к образованию газообразного циановодорода[1]:
- Взаимодействие с окислителями, например с перманганатом калия:
- Взаимодействие с сульфатом аммония приводит к образованию цианида аммония[3]:
Получение
- Цианид кальция получают взаимодействием оксида кальция с безводной синильной кислотой в присутствии небольших количеств аммиака или воды для предотвращения полимеризации.
- Взаимодействие карбида кальция с раствором синильной кислоты:
- Взаимодействие карбида кальция с азотом при 1100 °C (малораспространенный цианамидный метод):
- Реакции газообразного циановодорода с оксидом кальция при температуре около 400 °C.[4]
Примечания
- ↑ 1 2 3 . «Calcium Cyanide.» Chemical Book. 2010.http://www.chemicalbook.com/ChemicalProductProperty_EN_CB8105338.htm (accessed April 22, 2012).
- ↑ . «Calcium Cyanide.» Inchem. 2005.http://www.inchem.org/documents/icsc/icsc/eics0407.htm (accessed April 22, 2012).
- ↑ . «Ammonium Cyanide» Handbook of inorganic chemicals. 2003. ftp://pvictor.homeftp.net/public/Sci_Library/ChemLibrary/Handbooks/Patnaik (недоступная ссылка) P. Handbook of inorganic chemicals (MGH, 2003)(T)(1125s).pdf (accessed April 22, 2012)
- ↑ . «Production of Hydrocyanic Acid» United States Patent Office. 1933.(accessed April 22, 2012).