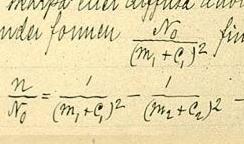Гравита́ция — универсальное фундаментальное взаимодействие между материальными телами, обладающими массой. В приближении малых, по сравнению со скоростью света, скоростей и слабого гравитационного взаимодействия описывается теорией тяготения Ньютона, в общем случае описывается общей теорией относительности Эйнштейна. В квантовом пределе гравитационное взаимодействие предположительно описывается квантовой теорией гравитации, которая ещё не разработана.
Ква́нтовая хи́мия — направление теоретической химии, рассматривающее строение и свойства химических соединений, реакционную способность, кинетику и механизм химических реакций на основе квантовой механики. Разделами квантовой химии являются: квантовая теория строения молекул, квантовая теория химических связей и межмолекулярных взаимодействий, квантовая теория химических реакций и реакционной способности и др. Она занимается рассмотрением химических и физических свойств веществ на атомарном уровне. Вследствие того, что сложность изучаемых объектов во многих случаях не позволяет находить явные решения уравнений, описывающих процессы в химических системах, применяют приближенные методы расчета. С квантовой химией неразрывно связана вычислительная химия — дисциплина, использующая математические методы квантовой химии, адаптированные для создания специальных компьютерных программ, используемых для расчета молекулярных свойств, амплитуды вероятности нахождения электронов в атомах, симуляции взаимодействия молекул.

Длина́ волны́ — расстояние между двумя ближайшими друг к другу точками в пространстве, в которых колебания происходят в одинаковой фазе.
Эмпирическая закономерность, правило большого пальца — зависимость, основанная на экспериментальных данных и позволяющая получить приблизительный результат, в типичных ситуациях близкий к точному.
Хими́ческая фо́рмула — условное обозначение химического состава и структуры соединений с помощью символов химических элементов, числовых и вспомогательных знаков. Химические формулы являются составной частью языка химии, на их основе составляются схемы и уравнения химических реакций, а также химическая классификация и номенклатура веществ. Одним из первых начал использовать их русский химик А. А. Иовский.

Пери́од колеба́ний — наименьший промежуток времени, за который система совершает одно полное колебание.
Ab initio — обоснование какого-либо явления из естественных законов природы без привлечения дополнительных эмпирических предположений или специальных моделей.

Фа́зовая ско́рость — скорость перемещения точки, обладающей постоянной фазой колебательного движения в пространстве, вдоль заданного направления. Обычно рассматривают направление, совпадающее с направлением волнового вектора, и фазовой называют скорость, измеренную именно в этом направлении, если противное не указано явно. Фазовая скорость по направлению волнового вектора совпадает со скоростью движения фазового фронта. Её можно рассматривать при желании как векторную величину.

Турбуле́нтность, устар. турбуле́нция, турбуле́нтное тече́ние — явление, когда при увеличении скорости течения жидкости образуются нелинейные фрактальные волны. Волны образуются обычные, линейные различных размеров, без наличия внешних сил и/или при наличии — сил, возмущающих среду. Волны появляются случайно, и их амплитуда меняется хаотически в некотором интервале. Они возникают чаще всего либо на границе, у стенки, и/или при разрушении или опрокидывании волны. Они могут образоваться на струях.

Йоха́ннес Ро́берт Ри́дберг — шведский физик. Наиболее известен открытием в 1888 году формулы Ридберга, которая описывает длины волн спектральных линий излучения атомов водорода.

Бо́ровская моде́ль а́тома — полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Эрнестом Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать энергию непрерывно и очень быстро и, потеряв её, упасть на ядро. Чтобы преодолеть эту проблему, Бор ввёл допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определённым (стационарным) орбитам, находясь на которых они не излучают энергию, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причём, стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка:  .
.

Спектра́льные се́рии водо́рода — набор спектральных серий, составляющих спектр атома водорода. Поскольку водород — наиболее простой атом, его спектральные серии наиболее хорошо изучены. Они хорошо подчиняются формуле Ридберга:

- где R = 109 677 см−1 — постоянная Ридберга для водорода,
- n′ — основной уровень серии, n — натуральное число больше n′.
Се́рия Ба́льмера — одна из спектральных серий атома водорода, наблюдающаяся для переходов между вторым энергетическим уровнем атома и вышележащими уровнями. В отличие от ультрафиолетовой серии Лаймана, связанной с переходами на основной уровень, четыре первые линии серии Бальмера лежат в видимой области спектра.
Действие в физике — скалярная физическая величина, являющаяся мерой движения физической системы. Действие является математическим функционалом, который берёт в качестве аргумента траекторию движения физической системы и возвращает в качестве результата вещественное число.

Иоганн Якоб Бальмер — швейцарский математик и физик.
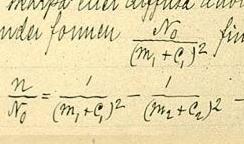
Фо́рмула Ри́дберга — эмпирическая формула, описывающая длины волн в спектрах излучения атомов химических элементов. Предложена шведским учёным Йоханнесом Ридбергом и представлена 5 ноября 1888 года.
Возникнове́ние ква́нтовой фи́зики — процесс длительный и постепенный, который занял свыше 25 лет. От первого возникновения понятия кванта до разработки так называемой копенгагенской интерпретации квантовой механики прошло 27 лет, заполненных интенсивной работой учёных всей Европы. В развитии и понимании квантовой теории приняли участие очень многие люди, как старшего поколения — Макс Борн, Макс Планк, Пауль Эренфест, Эрвин Шрёдингер, так и совсем молодые, ровесники квантовой гипотезы — Вернер Гейзенберг (1901), Вольфганг Паули (1900), Поль Дирак (1902) и т. д.

«Какова длина побережья Великобритании? Статистическое самоподобие и фрактальная размерность» — статья французско-американского математика Бенуа Мандельброта, впервые опубликованная в журнале Science в 1967 году. В этой статье Мандельброт рассматривает самоподобные кривые, которые имеют размерность Хаусдорфа между 1 и 2. Эти кривые представляют собой фракталы, хотя сам термин «фрактал» Мандельброт ввёл в употребление лишь в 1975 году. Статья Мандельброта является одной из первых его публикаций по тематике фракталов.